1*- Dra. María Beatriz Ludert, 2**- Dra. Elsie Beatriz Picott Rangel, 3***- Dra. Liliana Castillo Delpino.
1*- Dpto. de Ciencias Morfológicas y Forenses de la Universidad de Carabobo. Escuela de Ciencias Biomédicas y Tecnológicas. Profesor Instructor.
2**- Servicio de Anatomía Patológica Hospital Dr. Rafael G. Plaza
3***- Servicio de Neumonología Hospital Dr. Rafael G. Plaza
RESUMEN
Las malformaciones pulmonares congénitas tienen una incidencia de un 2,2%, y son menos frecuentes que las enfermedades pulmonares adquiridas. Existe un grupo de estas malformaciones que se han denominado malformaciones broncopulmonares del intestino anterior que comprenden los quistes broncogénicos pulmonares, secuestros pulmonares intra y extralobares, quistes de duplicación y la malformación adenoidea quística pulmonar. También esta descrita la hipoplasia pulmonar, como una rara anomalía congénita del desarrollo pulmonar. El objetivo de nuestro trabajo es describir casos interesantes diagnosticados en nuestro hospital, los cuales fueron estudiados desde el punto de vista clínico, radiológico y anatomopatológico (macroscópico y microscópico); lo cual, dado la particularidad de los mismos y su completa forma de estudio, resulta de sumo interés para el lector.
PALABRAS CLAVE: Malformaciones pulmonares congénitas, quiste broncogénico, secuestro pulmonar, hipoplasia pulmonar.
INTRODUCCIÓN
La formación y desarrollo pulmonar comporta múltiples bifurcaciones de las yemas bronquiales, con desarrollo posterior de los alvéolos y su expansión al momento del nacimiento. Asimismo, la vascularización doble característica va paralela al desarrollo del órgano. Anomalías en cada uno de estos procesos dan lugar a lesiones congénitas cuyo diagnostico se realiza en etapas tempranas de la vida cuando son lesiones graves o en estado adulto cuando son leves pero sufren complicaciones.
En esta publicación, nos referiremos exclusivamente a casos incluidos en nuestra casuística como son la hipoplasia pulmonar, el secuestro pulmonar, los quistes broncogénicos y un caso de malformación vascular.
• La hipoplasia pulmonar: es una rara anomalía congénita del desarrollo pulmonar en la que existe una disminución en el número o tamaño de las vías aéreas, alvéolos o vasos pulmonares, aunque la morfología grosera del pulmón es normal. La hipoplasia pulmonar puede ser primaria o secundaria. En el primer caso no existe patología coexistente y la mayoría de los pacientes mueren de forma precoz. Por el contrario, en la hipoplasia pulmonar secundaria se ha descrito un amplio espectro de anomalías asociadas que posiblemente están implicadas en su patogenia.
En modelos animales de experimentación se ha demostrado que en la vida intrauterina, tanto la injuria medular cervical como la sección bilateral del nervio frénico inducen el desarrollo de una la hipoplasia pulmonar. De esta forma, el sistema nervioso central, al mantener los movimientos respiratorios normales en el feto, parece jugar un importante papel en el desarrollo pulmonar. Por ello, se ha especulado que anomalías no evidentes en el control del sistema nervioso central pudieran estar implicadas en la patogenia de la hipoplasia pulmonar primaria. En el caso de la hipoplasia pulmonar secundaria, un espacio torácico insuficiente (hernia diafragmática, polihidramnios), enfermedades neuromusculares o neurológicas (anencefalia) o la agenesia renal pueden ocasionar la hipoplasia. Además, es probable que en algún caso existan defectos bioquímicos y metabólicos, como una disminución en la síntesis de prolina. Un estudio histopatológico realizado por Tarroch et al demostró que la hipoplasia pulmonar se caracteriza por una hipoalveolización. El recuento alveolar demostró 4,6 alvéolos por acino, con espacios aéreos anormalmente grandes, al contrario que sucede en otros tipos de hipoplasia pulmonar en los que existe una disminución del tamaño alveolar.
El desarrollo embriológico del pulmón se inicia a los 24 días de gestación, a partir de una invaginación del intestino anterior, y evoluciona en distintos estadios: embrionario (hasta la semana 8), pseudoglandular (hasta la semana 16), canalicular, sacular y alveolar Cualquier factor que interfiera el normal desarrollo ocasionará diferentes malformaciones que generalmente se manifiestan en la infancia. Cuando la agresión acontece durante el estadio pseudoglandular ocasiona una hipoplasia pulmonar, con reducción de las divisiones bronquiales, la complejidad acinar y la vascularización pulmonar, tal como se observa en los pacientes de la serie de Rubio et al. En la literatura existen múltiples casos de hipoplasia pulmonar en neonatos. Sin embargo, el diagnóstico en personas mayores de 18 años es un hallazgo extraordinariamente raro. De hecho, en una reciente revisión bibliográfica, Comet et al sólo pudieron documentar 48 casos de hipoplasia pulmonar diagnosticada en el adulto.
• Secuestro Pulmonar: Constituye el 6% de las malformaciones pulmonares congénitas. Se presenta como una malformación en la que una parte del tejido pulmonar esta irrigada por una o más arterias sistémicas anómalas, principalmente a partir de la aorta torácica descendente, y en un 10-15% de los secuestros intralobares, de la aorta abdominal. Existen dos formas de secuestro: intralobar y extralobar. En la forma intralobar, la más frecuente, el secuestro está incorporado dentro del tejido pulmonar normal circundante, con el que comparte una misma envoltura pleural. Habitualmente no comunican con el árbol traqueo-bronquial normal. Los secuestros intralobares se localizan con mayor frecuencia en segmentos basales mediales o basales posteriores del lóbulo inferior izquierdo, y generalmente debutan como neumonías a repetición o abscesos pulmonares que afectan el área del secuestro y al pulmón adyacente, realizándose el diagnóstico en la mayor parte de los casos por encima de los dos años de edad. Clínicamente se presenta por infecciones repetidas, hemoptisis, síntomas vagos como cansancio fácil, ahogos, dedos hipocráticos, etc. Radiológicamente se presenta como una zona de condensación o áreas quísticas sobreinfectadas que pueden tener niveles en su interior. La prueba diagnóstica definitiva y patognomónica es la arteriografía, que demuestra los vasos nutricios del secuestro, aunque recientemente la ecografía doppler está alcanzando un papel importante en el diagnóstico y seguimiento de esta patología. El tratamiento es quirúrgico e idealmente debe realizarse antes de que aparezcan complicaciones.
• Quistes Broncogénicos: Corresponden a lesiones quísticas pulmonares o mediastínicas revestidas por epitelio columnar ciliado de tipo bronquial. Se desarrollan a partir de una gemación anómala del intestino primitivo. Si esta separación ocurre en forma precoz el quiste permanece en el mediastino, y si ocurre en forma tardía, da origen a los quistes de ubicación periférica. Los quistes poseen una delgada pared propia con cartílago, musculatura lisa y glándulas bronquiales. Pueden tener comunicación con la vía aérea y si la formación del quiste fue muy precoz pueden existir zonas con epitelio gástrico o esofágico. Los quistes suelen ser redondeados, uniloculares y el contenido puede ser aéreo, seroso o mucoso. A menudo son únicos, de localización mediastínica derecha preferencial. Se ubican a lo largo de la tráquea, cerca de la carina o el hilio entre la vía aérea y el esófago. La mayoría de estos quistes se pesquisan como hallazgo radiológico, ya sea por una imagen quística pulmonar única. Una TAC con contraste delimita el quiste. El tratamiento debe ser quirúrgico para evitar las complicaciones, que incluyen la malignización. Habitualmente se realiza la quistectomía pero a veces es necesario una lobectomía dependiendo de la ubicación, tamaño y condiciones del quiste.
• Malformación Arterio-Venosa: consisten en la presencia de un pasaje (fístula) anormal entre una arteria y una vena en los vasos sanguíneos pulmonares, lo que produce una desviación de la sangre, de tal manera que ésta no se oxigena de manera adecuada. Las fístulas arteriovenosas pulmonares son malformaciones congénitas (están presentes al momento del nacimiento) que son el resultado del desarrollo anormal de los vasos sanguíneos del pulmón. Los pacientes que padecen la enfermedad de Rendu-Osler-Weber, también llamada telangiectasia hemorrágica hereditaria (THH), con frecuencia tienen vasos sanguíneos anormales en muchos lugares del cuerpo, incluyendo los pulmones, el cerebro, los conductos nasales, el hígado y los órganos gastrointestinales. Esta enfermedad es ligeramente más común en mujeres que en hombres. Muchos pacientes son asintomáticos, pero algunos pueden presentar dificultad respiratoria, respiraciones cortas con el esfuerzo excesivo, baja tolerancia al ejercicio o esputo con sangre. La radiografía torácica generalmente revela la presencia de vasos sanguíneos anormales y una TC torácica confirma la presencia de vasos sanguíneos anormales. Un arteriograma pulmonar (radiografía en movimiento tomada después de haber inyectado un medio de contraste) se utiliza para obtener un "mapa de ruta" de los vasos sanguíneos anormales antes de realizar una cirugía o cualquier otro tratamiento. Es posible que algunos de los pacientes asintomáticos no necesiten ningún tratamiento específico. Para la mayoría de los pacientes con fístulas ya sea única o múltiple, el mejor tratamiento es la cirugía para extirpar los vasos anormales y el tejido pulmonar adyacente. En algunos pacientes, también es posible realizar un bloqueo de la fístula al momento del arteriograma. Macroscópicamente la malformación arteriovenosa muestra vasos de diferentes tamaños anormalmente dilatados e histológicamente se aprecia engrosamiento variable de las túnicas vasculares.
CASOS CLÍNICOS:
HIPOPLASIA PULMONAR: Se trata de paciente femenina de 39 años de edad quien refiere inicio de Enfermedad Actual 15 días antes de su ingreso al presentar tos con expectoración mucopurulenta hemoptoica, dolor a nivel del hemitórax izquierdo a predominio postero-inferior, hipertermia cuantificada (38,5ºC) y disnea de medianos a pequeños esfuerzos por lo que acude al Hospital Dr. Rafael González Plaza, donde previa valoración se decide su ingreso. Diagnóstico de Ingreso: Hipoplasia pulmonar izquierda mas infección sobreagregada. Antecedentes de Importancia. Personales: Hospitalización previa en el año 2003 con sintomatología igual a la actual. Familiares: Madre viva portadora de diabetes mellitus no insulindependiente (DMNID), padre muerto por Cáncer gástrico. Hijos (03) aparentemente sanos. Hábitos psicobiológicos: Biomasa por 14 años. Ocupación: Costurera. Examen Funcional General (positivos): Cefaleas con EA, disnea a medianos y pequeños esfuerzos, tos con expectoración mucopurulenta, hemoptisis y dolor en hemitórax izquierdo. Examen Físico de Ingreso: Tórax asimétrico, hipoexpansible, sonido pulmonar disminuido en hemitórax izquierdo con crepitantes localizados en los 2/3 inferiores. Se decide practicar neumonectomía izquierda: El estudio anatomopatológico reporta: Hallazgos histológicos compatibles con HIPOPLASIA PULMONAR.
SECUESTRO PULMONAR: Se trata de paciente femenina de 28 años de edad quien refiere inicio de Enfermedad Actual unas semanas antes de su ingreso al presentar disnea de moderados esfuerzos concomitantemente con hipertermia cuantificada (39ºC), por lo que acude a facultativo quien indica Tratamiento Médico sin obtener mejoría franca; motivo por el cual acude al hospital Dr. Rafael González Plaza, dónde previa valoración se decide su ingreso. Diagnóstico de Ingreso: Infección Respiratoria Baja. (Neumonía Izquierda). Antecedentes. Personales: Infecciones respiratorias a repetición desde la infancia (múltiples hospitalizaciones). Familiares: No Contributorios. Hábitos Psicobiológicos: Niega. Examen Físico de Ingreso (positivos): Sonido pulmonar disminuido en región media e inferior del hemitórax izquierdo; se auscultan crepitantes dispersos y sibilantes. Plan de Trabajo: Se le practica estudio radiológico y tomográfico; posterior al cual se decide referir al servicio de Cirugía para resolución quirúrgica. Le es practicada toracotomía posterolateral izquierda siendo enviada la muestra de tejido a la Unidad de Anatomía Patológica y Citología dónde se reporta como: SECUESTRO PULMONAR INTRALOBAR.
QUISTE BRONCOGÉNICO: Se trata de paciente masculino de 23 años de edad quien refiere inicio de Enfermedad Actual una semana antes de su ingreso al presentar hipertermia no cuantificada, dolor torácico y tos productiva con expectoración mucopurulenta, motivo por el cual acude a este centro asistencial, donde previa valoración se decide su ingreso. Diagnóstico de Ingreso: Absceso pulmonar a descartar. Antecedentes de importancia. Personales: Neumonías a repetición, asma durante la infancia. Familiares: No Contributorios. Hábitos Psicobiológicos: No Contributorios. Examen Físico de Ingreso: Palidez cutáneo mucosa moderada. Se le realiza estudio radiológico y tomográfico, posterior a los cuales se practica Intervención Quirúrgica: Lobectomía Media e Inferior Derecha. El reporte de anatomía patológica fue: QUISTE BRONCOGÉNICO DE LÓBULO INFERIOR (QUISTE BRONQUIAL).
MALFORMACIÓN ARTERIOVENOSA: Se trata de paciente masculino de 26 años de edad quien refiere inicio de Enfermedad Actual 6 meses antes de su ingreso por presentar hipertermia, odinofagia y lipotimia por lo que es llevado al Hospital Naval en dónde se le practica Rx de tórax, posterior a la cual se refiere al Hospital de Pto. Cabello para su evaluación con el diagnóstico de Neumonía Derecha. Durante su estadía hospitalaria le es practicado estudio tomográfico, posterior al cual se decide practicar, previa Broncofibroscopia que no evidencia lesión endobronquial; Toracotomía Posterolateral Derecha. Ingresa a Quirófano con el diagnóstico clínico de Lesión de Ocupación de Espacio en Lóbulo Medio e Inferior Derecho. Los hallazgos intraoperatorios revelan que se trata de una lesión pulsátil. El espécimen es enviado al Servicio de Patología, donde posterior a su estudio se diagnostica como MALFORMACIÓN ARTERIOVENOSA.
HIPOPLASIA PULMONAR: Se trata de paciente femenina de 39 años de edad quien refiere inicio de Enfermedad Actual 15 días antes de su ingreso al presentar tos con expectoración mucopurulenta hemoptoica, dolor a nivel del hemitórax izquierdo a predominio postero-inferior, hipertermia cuantificada (38,5ºC) y disnea de medianos a pequeños esfuerzos por lo que acude al Hospital Dr. Rafael González Plaza, donde previa valoración se decide su ingreso. Diagnóstico de Ingreso: Hipoplasia pulmonar izquierda mas infección sobreagregada. Antecedentes de Importancia. Personales: Hospitalización previa en el año 2003 con sintomatología igual a la actual. Familiares: Madre viva portadora de diabetes mellitus no insulindependiente (DMNID), padre muerto por Cáncer gástrico. Hijos (03) aparentemente sanos. Hábitos psicobiológicos: Biomasa por 14 años. Ocupación: Costurera. Examen Funcional General (positivos): Cefaleas con EA, disnea a medianos y pequeños esfuerzos, tos con expectoración mucopurulenta, hemoptisis y dolor en hemitórax izquierdo. Examen Físico de Ingreso: Tórax asimétrico, hipoexpansible, sonido pulmonar disminuido en hemitórax izquierdo con crepitantes localizados en los 2/3 inferiores. Se decide practicar neumonectomía izquierda: El estudio anatomopatológico reporta: Hallazgos histológicos compatibles con HIPOPLASIA PULMONAR.
SECUESTRO PULMONAR: Se trata de paciente femenina de 28 años de edad quien refiere inicio de Enfermedad Actual unas semanas antes de su ingreso al presentar disnea de moderados esfuerzos concomitantemente con hipertermia cuantificada (39ºC), por lo que acude a facultativo quien indica Tratamiento Médico sin obtener mejoría franca; motivo por el cual acude al hospital Dr. Rafael González Plaza, dónde previa valoración se decide su ingreso. Diagnóstico de Ingreso: Infección Respiratoria Baja. (Neumonía Izquierda). Antecedentes. Personales: Infecciones respiratorias a repetición desde la infancia (múltiples hospitalizaciones). Familiares: No Contributorios. Hábitos Psicobiológicos: Niega. Examen Físico de Ingreso (positivos): Sonido pulmonar disminuido en región media e inferior del hemitórax izquierdo; se auscultan crepitantes dispersos y sibilantes. Plan de Trabajo: Se le practica estudio radiológico y tomográfico; posterior al cual se decide referir al servicio de Cirugía para resolución quirúrgica. Le es practicada toracotomía posterolateral izquierda siendo enviada la muestra de tejido a la Unidad de Anatomía Patológica y Citología dónde se reporta como: SECUESTRO PULMONAR INTRALOBAR.
QUISTE BRONCOGÉNICO: Se trata de paciente masculino de 23 años de edad quien refiere inicio de Enfermedad Actual una semana antes de su ingreso al presentar hipertermia no cuantificada, dolor torácico y tos productiva con expectoración mucopurulenta, motivo por el cual acude a este centro asistencial, donde previa valoración se decide su ingreso. Diagnóstico de Ingreso: Absceso pulmonar a descartar. Antecedentes de importancia. Personales: Neumonías a repetición, asma durante la infancia. Familiares: No Contributorios. Hábitos Psicobiológicos: No Contributorios. Examen Físico de Ingreso: Palidez cutáneo mucosa moderada. Se le realiza estudio radiológico y tomográfico, posterior a los cuales se practica Intervención Quirúrgica: Lobectomía Media e Inferior Derecha. El reporte de anatomía patológica fue: QUISTE BRONCOGÉNICO DE LÓBULO INFERIOR (QUISTE BRONQUIAL).
MALFORMACIÓN ARTERIOVENOSA: Se trata de paciente masculino de 26 años de edad quien refiere inicio de Enfermedad Actual 6 meses antes de su ingreso por presentar hipertermia, odinofagia y lipotimia por lo que es llevado al Hospital Naval en dónde se le practica Rx de tórax, posterior a la cual se refiere al Hospital de Pto. Cabello para su evaluación con el diagnóstico de Neumonía Derecha. Durante su estadía hospitalaria le es practicado estudio tomográfico, posterior al cual se decide practicar, previa Broncofibroscopia que no evidencia lesión endobronquial; Toracotomía Posterolateral Derecha. Ingresa a Quirófano con el diagnóstico clínico de Lesión de Ocupación de Espacio en Lóbulo Medio e Inferior Derecho. Los hallazgos intraoperatorios revelan que se trata de una lesión pulsátil. El espécimen es enviado al Servicio de Patología, donde posterior a su estudio se diagnostica como MALFORMACIÓN ARTERIOVENOSA.
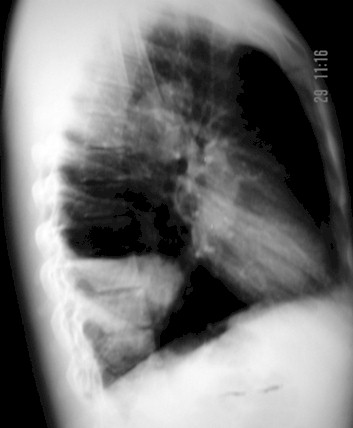
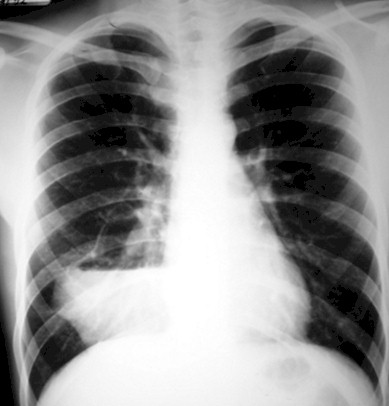
Figura 1. Fuente: Archivos del Servicio de Anatomía Patológica. Hospital Dr. Rafael González Plaza

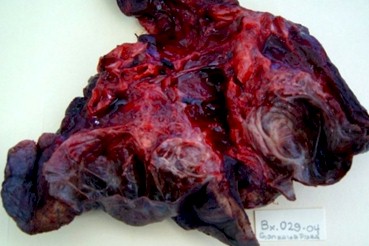
Figura 2. Fuente: Archivos del Servicio de Anatomía Patológica. Hospital Dr. Rafael González Plaza
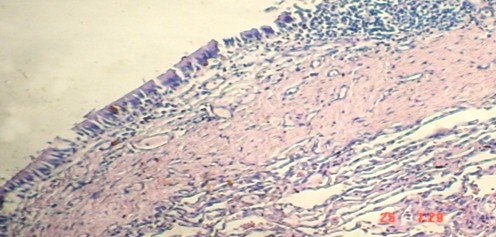
Fig. 3. Se observa hacia uno de los extremos epitelio cilíndrico ciliado de tipo respiratorio, subyacente al cual apreciamos tejido conectivo vascularizado con infiltrado inflamatorio y parénquima pulmonar. H-E 400X
Fuente: Archivos del Servicio de Anatomía Patológica. Hospital Dr. Rafael González Plaza
BIBLIOGRAFÍA
1. Moreno BE, Pérez TA. Evolución histórica en el centenario de la broncoscopía; pasado, presente y futuro. Arch Bronconeumol 1998; 34: 300-306
2. Fossella FV, Komaki R, Putnam JB Jr. Lung cancer. New York: Springer-Verlag; 2003.
3. Wang KP, Mehta AC, Turner JF Jr. Flexible bronchoscopy. 2nd ed. Mass. New York: Blackwell Science; 2004.
4. Richardsin RH, Zavalla DC, Mockeries PK, Befell GN. The use of fiber optic bronchoscope and brush biopsy in the diagnosis of suspected pulmonary malignancy. Am J Respir Crypt Care Med 1974; 109:63-6
5. Chopra SK, Genovesi MG, Simmons DH, Gothe B. Fiberoptic bronchoscopy in the diagnosis of lung cancer. Comparison of pre and post-bronchoscopy sputa, techniques used in association with flexible fiberoptic bornchoscopy. Chest 1076; 69:752-7.
6. Zavala DC. Diagnostic fiberoptic bronchoscopy. Techniques and results of biopsy in 600 patients. Chest 1975; 68:12-9
7. Richardson RH, Zavala DC, Mukerjee PK, Bedell GN. The use of fiberoptic bronchoscopy and brush biopsy in the diagnosis of suspected pulmonary malignancy. Am Rev REspir Dis 1974; 109:63-6
8. Rey de Castro J, Misayato C. Broncofibroscopia Ambulatoria. Rev Med Hered 1991; 2(4):156-9.
9. Boirke W, Milstein D. Lung cancer in young adults. Chest 1992;102:1723-7
10. Wassermann K, Gassanov N, Atay Z, Topalidis T, Dienes HP, Mathem F. The impact of cytology on the bronchoscopic diagnosis of lung cancer. J Bronchol 2004; 3:154-159.
11. García Marrón M, Gallo Martín F, García Muñoz JP, Viejo Bañuelos JL. Estudio de las técnicas de diagnóstico en cien pacientes con carcinoma bronquial. Arch Bronconeumol 1986; 22: 17-23.
12. Romero Candeira S, Padilla Navas I, Jiménez Cruzado L, Pajes Juanola MA, Vilaplana Vilaplana E, Cabezas Jiménez A. Rentabilidad diagnóstica de la broncofibroscopia en el carcinoma bronquial. Rev Clín Esp 1984; 174: 243-246.
13. Popovich J, Kvale PA, Eichenhorn MS, Radke JR, Ohorodnik M, Fine G. Diagnostic accuracy of multiple biopsies from flexible fiberoptic bronchoscopy. Am Rev Respir Dis 1982; 125: 521-523.
14. Martínez Moragón E, Aparicio Urtasun J, Sanchís Aldás J et al. Fibrobroncoscopia en el cáncer de pulmón: relación entre radiología, endoscopia, histología y rendimiento diagnóstico en una serie de 1.801 casos. Arch Bronconeumol 1994; 30: 291-296.
15. Buccheri G, Barberis P, Delfino MS. Diagnostic, morphologic and histopathologic correlates in bronchogenic carcinoma. A review of 1,045 bronchoscopic examinations. Chest 1991; 99: 809-814.
16. Robbins HM, Morrison DA, Sweet ME, Solomon DA, Goldman AL. Biopsy of the main carina; staging lung cancer with the fiberoptic bronchoscope. Chest. 1979;75(4):484-486.
17. Fiorino AR, Grimberg CE, Isidoro R, Debais MC. Valoración de la biopsia de carina aspecto normal en el cáncer broncopulmonar. Rev Argent Tórax. 1997:58(1):5-10
Fuente: Archivos del Servicio de Anatomía Patológica. Hospital Dr. Rafael González Plaza
BIBLIOGRAFÍA
1. Moreno BE, Pérez TA. Evolución histórica en el centenario de la broncoscopía; pasado, presente y futuro. Arch Bronconeumol 1998; 34: 300-306
2. Fossella FV, Komaki R, Putnam JB Jr. Lung cancer. New York: Springer-Verlag; 2003.
3. Wang KP, Mehta AC, Turner JF Jr. Flexible bronchoscopy. 2nd ed. Mass. New York: Blackwell Science; 2004.
4. Richardsin RH, Zavalla DC, Mockeries PK, Befell GN. The use of fiber optic bronchoscope and brush biopsy in the diagnosis of suspected pulmonary malignancy. Am J Respir Crypt Care Med 1974; 109:63-6
5. Chopra SK, Genovesi MG, Simmons DH, Gothe B. Fiberoptic bronchoscopy in the diagnosis of lung cancer. Comparison of pre and post-bronchoscopy sputa, techniques used in association with flexible fiberoptic bornchoscopy. Chest 1076; 69:752-7.
6. Zavala DC. Diagnostic fiberoptic bronchoscopy. Techniques and results of biopsy in 600 patients. Chest 1975; 68:12-9
7. Richardson RH, Zavala DC, Mukerjee PK, Bedell GN. The use of fiberoptic bronchoscopy and brush biopsy in the diagnosis of suspected pulmonary malignancy. Am Rev REspir Dis 1974; 109:63-6
8. Rey de Castro J, Misayato C. Broncofibroscopia Ambulatoria. Rev Med Hered 1991; 2(4):156-9.
9. Boirke W, Milstein D. Lung cancer in young adults. Chest 1992;102:1723-7
10. Wassermann K, Gassanov N, Atay Z, Topalidis T, Dienes HP, Mathem F. The impact of cytology on the bronchoscopic diagnosis of lung cancer. J Bronchol 2004; 3:154-159.
11. García Marrón M, Gallo Martín F, García Muñoz JP, Viejo Bañuelos JL. Estudio de las técnicas de diagnóstico en cien pacientes con carcinoma bronquial. Arch Bronconeumol 1986; 22: 17-23.
12. Romero Candeira S, Padilla Navas I, Jiménez Cruzado L, Pajes Juanola MA, Vilaplana Vilaplana E, Cabezas Jiménez A. Rentabilidad diagnóstica de la broncofibroscopia en el carcinoma bronquial. Rev Clín Esp 1984; 174: 243-246.
13. Popovich J, Kvale PA, Eichenhorn MS, Radke JR, Ohorodnik M, Fine G. Diagnostic accuracy of multiple biopsies from flexible fiberoptic bronchoscopy. Am Rev Respir Dis 1982; 125: 521-523.
14. Martínez Moragón E, Aparicio Urtasun J, Sanchís Aldás J et al. Fibrobroncoscopia en el cáncer de pulmón: relación entre radiología, endoscopia, histología y rendimiento diagnóstico en una serie de 1.801 casos. Arch Bronconeumol 1994; 30: 291-296.
15. Buccheri G, Barberis P, Delfino MS. Diagnostic, morphologic and histopathologic correlates in bronchogenic carcinoma. A review of 1,045 bronchoscopic examinations. Chest 1991; 99: 809-814.
16. Robbins HM, Morrison DA, Sweet ME, Solomon DA, Goldman AL. Biopsy of the main carina; staging lung cancer with the fiberoptic bronchoscope. Chest. 1979;75(4):484-486.
17. Fiorino AR, Grimberg CE, Isidoro R, Debais MC. Valoración de la biopsia de carina aspecto normal en el cáncer broncopulmonar. Rev Argent Tórax. 1997:58(1):5-10

No hay comentarios:
Publicar un comentario